El cáncer es una de las causas de muerte, con mayor frecuencia, alrededor del mundo. La cirugía es una estrategia clínica para combatir los tumores sólidos. Sin embargo, existe la posibilidad de la recurrencia local del tumor o metástasis de este debido a células cancerosas residuales y células circulantes tumorales, ya sea en el mismo lugar o alejado del mismo (metástasis). Además, existe evidencia que el procedimiento quirúrgico promueve la recurrencia después de la remoción tumoral, esto es causado por mecanismos de defensa que causan la supervivencia del tumor, células “ocultas” durante el procedimiento y el uso de anestesia. En consecuencia, además de la cirugía debe proveerse una terapia combinada con radioterapia o quimioterapia para eliminar estas células remanentes (Hiller J, et al, 2018).
Actualmente, la quimioterapia es el método más común para estas condiciones debido a su alta eficacia terapéutica, aun así, no está exenta de complicaciones y efectos adversos, esto es debido, a que los fármacos no están dirigidos específicamente a células cancerosas y el fármaco pasa por todo el cuerpo, lo que deriva en situaciones en donde disminuye la calidad de vida del paciente, pues de forma concomitante puede tener daños a la mucosa gástrica, riñones, hígado, cerebro, entre otros. Una alternativa es la aplicación local de las quimioterapias, esto se puede lograr con el diseño de sistemas de entrega de fármaco (SEF) (Anand U, et al, 2022).
Sistema de entrega de fármacos
Un SEF es una plataforma realizada a partir de materiales orgánicos o inorgánicos para almacenar o acarrear un fármaco ya sea de forma local o sistémica y liberarlo en su lugar blanco. Sin embargo, para diseñar sistemas de entrega de fármacos para tumores, es importante entender el microambiente tumoral, el cual consiste en células malignas y otras células que han sido reclutadas. Este microambiente juega un papel importante en la progresión del tumor ya que provee un ambiente nutritivo para las células, además funciona en la comunicación entre células.
Fibras electrohiladas
Últimamente, el desarrollo y uso de fibras electrohiladas han atraído la atención como un sistema de entrega novedoso para el tratamiento de tumores. El electrohilado es una técnica de uso sencillo, la cual convierte soluciones hechas con polímeros y otros aditivos en membranas constituidas por miles de fibras que tienen un diámetro que van desde los nanómetros a los micrómetros. Cuando estas membranas poliméricas se utilizan dentro del cuerpo (implantes), se deben usar materiales poliméricos que sean biocompatibles y biodegradables. Estas fibras pueden ser cargadas de fármacos, y mediante la liberación prolongada y/o controlada en el sitio blanco, pueden controlar la proliferación celular.
Las ventajas de utilizar las membranas como una formulación implantable de uso local son: aumento de concentración del fármaco en el tejido de resección, menos efectos secundarios a otros tejidos y liberación controlada del fármaco (Zhao J, et al, 2020).
Los fármacos anticancerosos y moléculas más utilizadas para esta aplicación son el resveratrol, doxorrubicina, 5 – fluoracilo, curcumina, quercetina, piperina, gemcitabina, cisplatino, combrestatina A4, entre muchas otras. Las fibras electrohiladas han evolucionado al ser probados para la terapia local de cáncer. Los perfiles de liberación de fármacos o moléculas necesitan de estos cambios, partiendo desde simples mezclas polímero - fármaco a estructuras que incluyen multicapas, así modificando sus propiedades de humectación o mecánicas. (Luo H, et al, 2021).
Finalmente, existen los llamados sistemas de entrega “inteligentes”, los cuales dependen de un estímulo para liberar el fármaco que contienen. Los estímulos pueden ser de dos tipos, endógenos y exógenos. Los primeros provienen del mismo microambiente tumoral el cual es diferente a un tejido sano y estos cambios implican, por ejemplo, un bajo pH. Por otra parte, los exógenos provienen de alteraciones físicas controladas como la aplicación de luz infrarroja (aumento de temperatura), campos magnéticos o luz UV, los cuales excitan a moléculas que se agregan dentro de las fibras para que estas se muevan y formen poros para la liberación de las sustancias activas (Weng L, et al, 2015).
Estos sistemas a base de fibras electrohiladas tienen propiedades superiores a la terapia sistémica, por lo que su uso es factible. Sin embargo, quedan retos que deben ser considerados antes de las pruebas clínicas en pacientes. Estos retos incluyen: estabilidad de los andamios; su toxicidad; observar de cerca la respuesta inmune en el lugar de implantación; la degradación dentro del cuerpo y su acumulación.
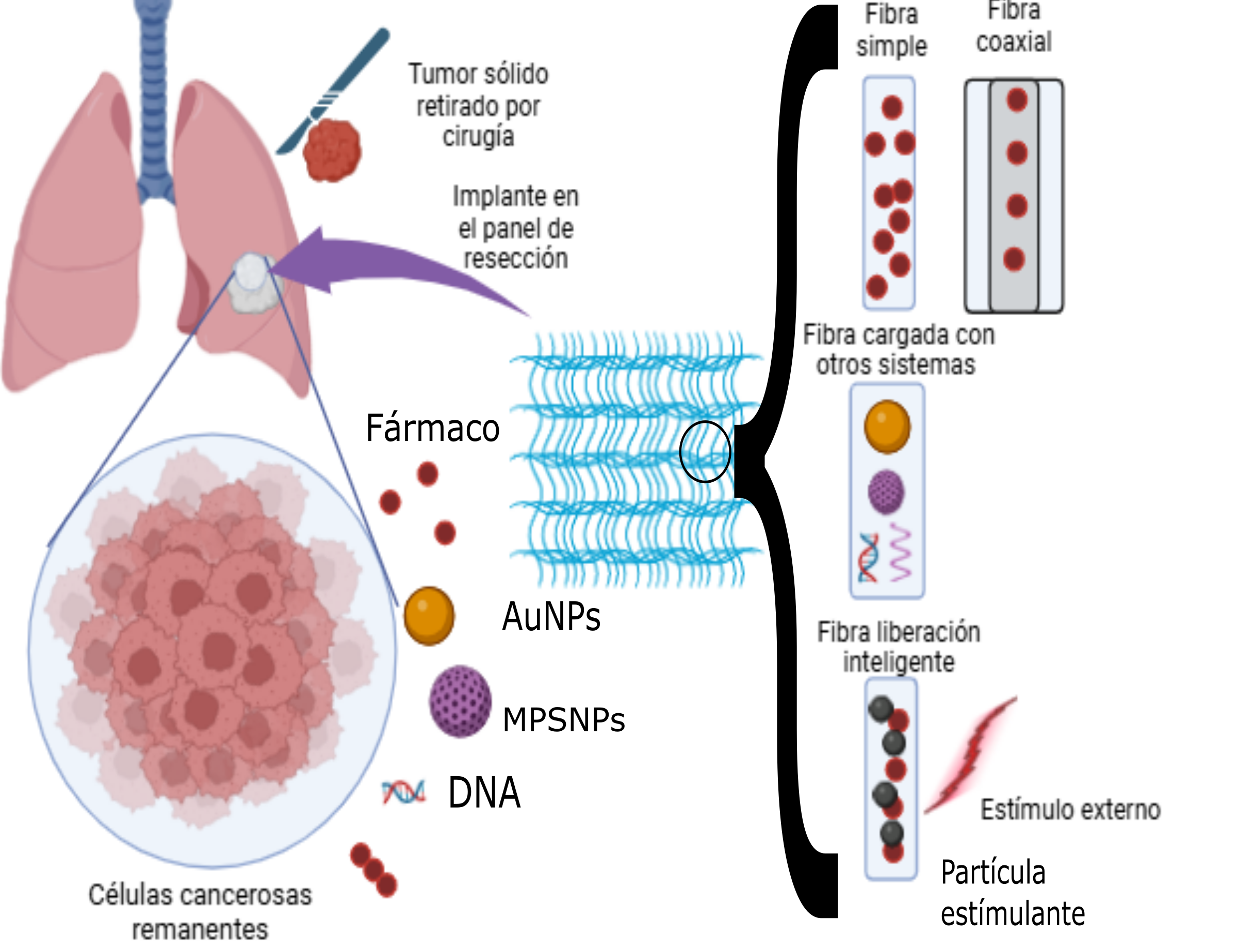
Figura 1. Tratamiento de células cancerosas residuales de forma local con fibras poliméricas. En la Figura se muestra como al usarse las fibras electrohiladas y cargadas, pueden disminuir el tamaño del tumor, o bien reducir la proliferación de las células cancerosas, mediante la muerte celular programada.
Referencias
[1] Hiller, J., Perry, N., Poulogiannis, G. et al. Perioperative events influence cancer recurrence risk after surgery. Nat Rev Clin Oncol 15, 205–218 (2018). https://doi.org/10.1038/nrclinonc.2017.194.
[2] Anand, U., Dey, A., Chandel, A. K. S., Sanyal, R., Mishra, A., Pandey, D. K., De Falco, V., Upadhyay, A., Kandimalla, R., Chaudhary, A., Dhanjal, J. K., Dewanjee, S., Vallamkondu, J., & Pérez de la Lastra, J. M. (2022). Cancer chemotherapy and beyond: Current status, drug candidates, associated risks and progress in targeted therapeutics. Genes & diseases, 10(4), 1367–1401. https://doi.org/10.1016/j.gendis.2022.02.007.
[3] Zhao, J., Cui, W. Functional Electrospun Fibers for Local Therapy of Cancer. Adv. Fiber Mater. 2, 229–245 (2020). https://doi.org/10.1007/s42765-020-00053-9.
[4] Luo, H., Jie, T., Zheng, L., Huang, C., Chen, G., & Cui, W. (2021). Electrospun Nanofibers for Cancer Therapy. Advances in experimental medicine and biology, 1295, 163–190. https://doi.org/10.1007/978-3-030-58174-9_8.
[5] Weng L, Xie J. Smart electrospun nanofibers for controlled drug release: recent advances and new perspectives. Curr Pharm Des. 2015;21(15):1944-59. doi: 10.2174/1381612821666150302151959.
